Введение
Nymphoides peltata (S. G. Gmel.) O. Kuntze (Limnanthemum peltatum S. G. Gmelin; Limnanthemum nymphoides (L.) Hoffsgg. & Link; Nymphoides peltata (S. G. Gmelin) Kuntze; Menyanthes nymphoides L.) – нимфейник или болотноцветник щитолистный – придаточно-корневой летнезимнезеленый эпигенно-короткокорневищный многолетник с удлиненными столоновидными побегами (Леднев, 2015). Произрастает в стоячих или медленно текущих водах речных стариц и заводей (Губанов и др., 2004) с повышенной щелочностью, иногда можно встретить в условиях слабой кислотности (Smith et al., 1988). N. peltata размножается, в основном, вегетативно с помощью удлиненных столоновидных побегов (Brock et al., 1983; Wu et al., 2006) и способен за один вегетационный сезон занимать большие водные площади (Cook, 1985). Конкретные описания фитоценозов с доминированием этого вида приведены в работах исследователей стран Западной Европы, большинство из Румынии (Krausch, 1965; Nedelcu, 1969).
N. peltata – плюризональный циркумполярный вид, его ареал охватывает умеренную зону Евразии (Li et al., 2011; Săndulescu et al., 2016), отмечен с конца XIX в. в Северной Америке и с 1988 г. в Новой Зеландии (Champion, Clayton, 2003; Darbyshire, Francis, 2008). На территории северо-востока Европейской части России встречается, в основном, по Северной Двине, отмечен в верхнем и нижнем течении реки Вычегда (Флора …, 1977). Нахождения вида в пределах его ареала на территории России спорадические, поэтому в некоторых регионах страны подлежит охране как вид редкий или находящийся на грани исчезновения.
Изучаемая популяция находится на границе ареала вида, поэтому здесь вид считается уязвимым и оценка современного состояния популяции, организация мониторинга в месте обнаружения вида представляет очевидную актуальность.
Объекты и методы исследований
N. peltata был обнаружен в 2014 г. на левом берегу реки Северная Двина в деревне Анфимовская (Архангельская область) – рис. 1.
Материалом для изучения анатомо-морфологических особенностей N. peltata послужили растения, собранные в 2014 и 2017 гг.
Проведено описание местообитания вида, у собранных растений проводились подсчет и измерения разных структурных модульных биоморфологических элементов: придаточных корней, вегетативных и генеративных столонов, листьев. Общая архитектурная модель растения принималась по С. А. Ледневу (2015). Учитывались следующие морфологические показатели: количество и длина придаточных корней на корневище и столонах, количество и линейные размеры листьев, длина черешков листьев, количество одновременно цветущих цветков.
Для изучения анатомической структуры вегетативных органов использована общепринятая методика (Фурст, 1979). Органы растений фиксировали в 70 % этаноле. Анатомическую структуру вегетативных органов изучали на поперечных и продольных анатомических срезах при помощи светового микроскопа Scope A1 (ZEISS, Германия).
Биометрические измерения анатомических показателей проводили с помощью окуляр-микрометра WF10X/22 мм в 50-кратной повторности. Для статистической обработки данных использовали программу MS Excel 2007. Фотографии сделаны Е. Ф. Марковской, К. В. Морозовой.
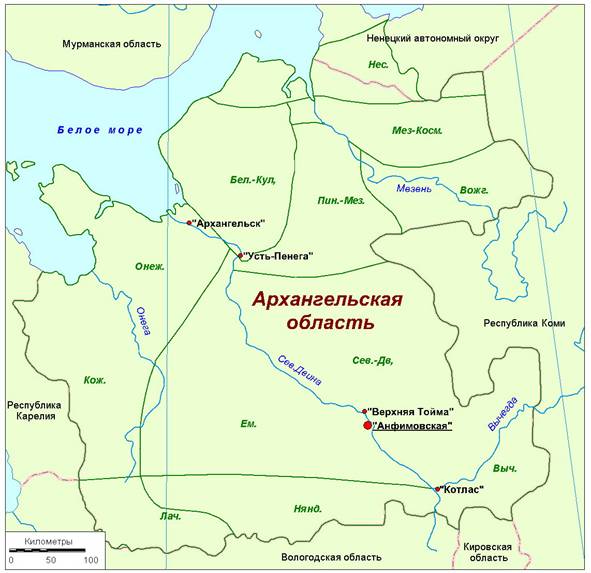
Рис. 1. Местонахождение ценопопуляции Nymphoides peltata (деревня Анфимовская, Архангельская область, Россия).
Флористические районы: Нес. – Несский; Мез.–Косм. – Мезенско-Косминский; Бел.–Кул. – Беломорско-Кулойский; Пин.–Мез. – Пинежско-Мезенский; Вожг. – Вожгорский; Онеж. – Онежский; Кож. – Кожозерский; Ем. – Емецкий; Сев.–Дв. – Северо-Двинский; Лач. – Лачский; Нянд. – Няндомский; Выч. – Вычегодский.
Результаты и обсуждение
Популяция N. peltata в исследованном местообитании находится на ранних этапах формирования, в 2014 году начат мониторинг за ее состоянием по ряду детерминированных для вида морфологических и анатомических признаков.
В выявленном сообществе, кроме доминирующего N. peltata, с небольшим обилием ближе к береговой линии отмечены Sparganium emersum Rehm., Alisma plantago-aquatica L., Hippuris vulgaris L., Carex acuta, Eleocharis palustris (L.) Roem. & Schult., Rorippa amphibia (L.) Bess., Agrostis stolonifera L. По берегу заросли видов рода Salix L., доминирует среди них Salix phylicifolia L.

Рис. 2. Популяция Nymphoides peltata у берега реки Северная Двина.

Рис. 3. Цветение Nymphoides peltata.
Площадь, занятая популяцией N. peltata в 2014 г. составляла примерно 20 м², проективное покрытие плавающих листьев в данном водоеме было около 50 %, местами доходило до 80 %, в 2017 г. площадь уже была больше, составляя 30–40 м2, проективное покрытие листьев местами доходило до 100 % с явным большим перекрытием листовых пластинок (рис. 2, 3).
Занятая растениями акватория включает глубины от 30 до 70 см, дальнейшее распространение на большие глубины ограничено. Увеличение площади популяции происходит путем ее продвижения по течению реки. Плотность листьев в начале наблюдения в 2014 г. составляла 1,4 м2 на 1 м2 площади водоема, в 2017г. в центральной части популяции в результате большого перекрытия она составила уже 1,8 м2, а в молодой части популяции текущего года – 1,3 м2. За счет расположения листьев практически в 2 яруса, масса листьев на единице площади водоема (воздушно-сухой массы на 1 м2) варьировала от 46 до 52 мг, а в центральной части популяции достигала 74 мг.
N. peltata относится к нимфеидной жизненной форме (Brock et al., 1983; Smith et al., 1988; Wu et al., 2006), растения имеют короткое корневище со столоновидными побегами, на которых формируются листья с длинными черешками. В структурной организации биоморфы N. peltata Леднев (2015) выделяет несколько основных модулей, среди которых укороченное корневище, вегетативный столон, столон-цветонос. Исходя из этого, результаты определения морфологических и анатомических признаков N. peltata представлены по модулям.
Укороченное корневище расположено всегда в субстрате на дне водоема и является базальной частью особи, на корневище образуются придаточные корни, листья, вегетативные столоны, столоны-цветоносы и пазушные почки. На коротком корневище количество придаточных корней отмечалось в пределах от 10 до 25 шт. длиной 12–25 см.
Корневище диаметром до 7 мм покрыто перидермой, клетки которой прямоугольной формы. Округлые клетки коры расположены в три ряда. Основную часть корневища занимает аэренхима с межклетниками (рис. 4), диаметр которых (182.0±6.9 мкм) меньше, чем в других вегетативных органах растения. Длина клеток аэренхимы в среднем составляет 58.1±0.7 мкм, ширина – 36.4±0.8 мкм. Астросклереиды единичные, длиной 281.2±7.0 мкм.
В центральной части образуется 9 коллатеральных проводящих пучков и между ними формируется сердцевина с округлыми клетками диаметром 32.0±0.6 мкм. Вокруг этих анатомических структур образуется однослойная эндодерма с овальными клетками. В клетках коры, аэренхимы и сердцевины содержится большое количество инулина в виде мелких округлых образований.
Придаточные корни диаметром до 5.6 мкм, образованы первичной корой (экзодерма, мезодерма, эндодерма), центральным цилиндром (перицикл, проводящий пучок). Экзодерма выполняет защитную функцию, состоит из 2 слоев плотно сомкнутых прямоугольных клеток с опробковевшими стенками. Наибольшую часть коры занимает мезодерма, клетки которой округлой формы и содержат инулин. Аэренхима в мезодерме имеет диаметр клеток 75.3±0.2 мкм, межклетники расположены в один ряд и достигают диаметра 262.0±10.0 мкм. Эндодерма представлена одним слоем клеток с утолщенными стенками. В центральной части корня находится один радиальный проводящий пучок, окруженный однослойным перициклом с овальными клетками. Jr. J. Seago с соавторами (Seago et al., 2005) указывают на образование в корнях растений видов семейства Menyanthaceae астросклереид, обеспечивающих механическую опору и защитную функцию этого вегетативного органа. При выполнении данного исследования таких элементов механической ткани в придаточных корнях N. рeltata не обнаружено.
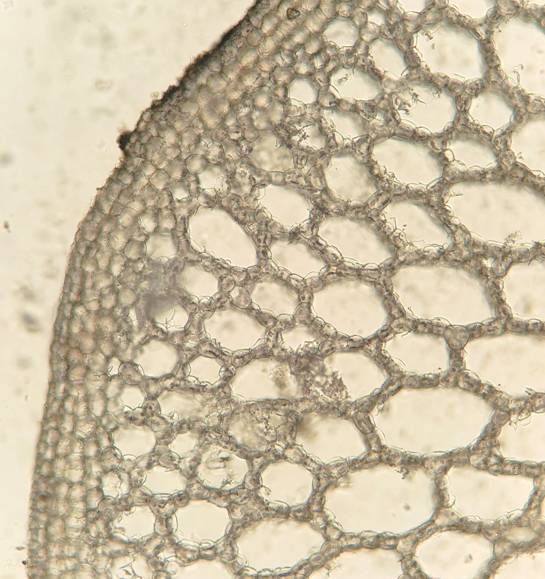
Рис. 4. Аэренхима в корневище Nymphoides peltata (увеличение 10х).
Вегетативный столон
Длина вегетативных столонов у N. peltata может достигать до 2-х и более метров. Количество придаточных корней в узлах составляло в большинстве 3–4 шт. (мин. – 2, макс. – 5 шт.), длина от 10 до18 см. Длина междоузлий на вегетативных столонах в среднем составляла 12 см (мин. 4,5 см, макс. – 18 см). Анатомическое строение придаточных корней, развивающихся на данных столонах, аналогично строению корней на корневищах.
Столон диаметром до 4.1 мм покрыт однослойной эпидермой, состоящей из прямоугольных клеток. Клетки коры расположены в два ряда. Значительную часть, как и в подземной части растения, занимает аэренхима с воздухоносными полостями, диаметр которых в среднем составляет 516.6±15.2 мкм, что почти в 2–3 раза превышает значение этого показателя анатомической структуры в придаточных корнях и корневище. При этом размеры клеток аэренхимы (длина 76.3±2.0 мкм, ширина 60.6±1.4 мкм) также больше в вегетативном столоне. Между межклетниками отмечены астросклереиды длиной 418.7±10.7 мкм. В центральной части столона находятся 5 коллатеральных проводящих пучков, между которыми образуются округлые клетки сердцевины диаметром 47.2±1.4 мкм. Проводящие пучки и сердцевина отделены от паренхимы однослойной эндодермой, образованной крупными клетками. E. B. Săndulescu с соавторами (Săndulescu et al., 2016) определили, что многие клетки эндодермы в стебле у N. рeltata имеют пояски Каспари.
Листья
Продолжительность жизни листьев N. peltata длится от 23 до 43 дней (Van Der Velde, Van Der Heijden, 1981). На начальном этапе формирования популяции, когда растения находились на глубине 30–50 см, длина черешка у листьев, отходящих от укоренившихся столонов, составляла от 25 до 40 см, у свободно плавающих столонов – от 12 до 20 см. По мере продвижения популяции на большие глубины, длина черешка листа в некоторых случаях доходила уже до 160 см. Диаметр листовых пластинок варьировал от 5 до 10 см, черешки листьев округлые со средним диаметром до 2 мм.
Листья дорзовентрального типа (рис. 5). Палисадный мезофилл расположен на адаксиальной стороне, губчатый – на абаксиальной. Толщина листовых пластинок составляет 1046.0±11.5 мкм. Они плотные и покрытые тонкой кутикулой. Верхняя эпидерма с многочисленными устьицами и состоит из одного слоя клеток с извилистыми стенками.
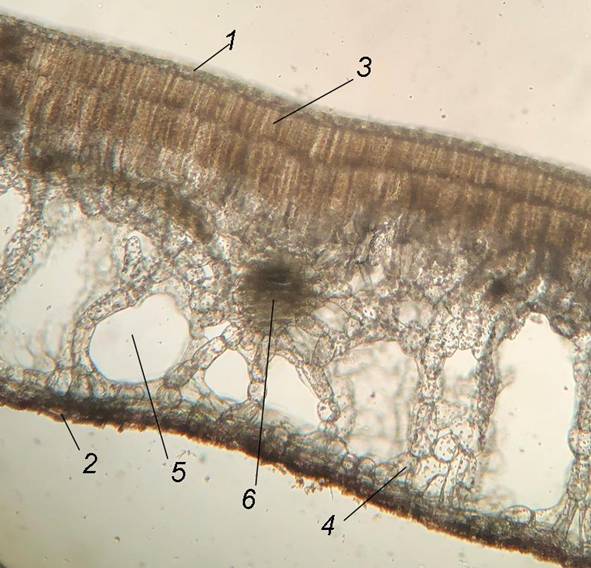
Рис. 5. Поперечный срез листа Nymphoides peltata (увеличение 4х).
1 – верхняя эпидерма, 2 – нижняя эпидерма, 3 – палисадный мезофилл, 4 – губчатый мезофилл, 5 – межклетник, 6 – проводящий пучок.
Нижняя эпидерма характеризуется более крупными по размерам многоугольными клетками, отсутствием устьиц и образованием гидропот, характерных для плавающих и погруженных листьев гидрофитов. Гидропоты представляют собой округлые группы более мелких клеток (длина 19.0±0.4 мкм, ширина 13.1±0.3 мкм) от 30 до 150 шт., через которые в листовую пластинку поступают вода и растворенные в ней минеральные соли (рис. 6).
Клетки палисадного мезофилла прямоугольной формы, расположены плотно в 2 ряда. Săndulescu с соавторами (Săndulescu et al., 2016) у данного вида отмечают до 4 слоев столбчатой паренхимы. Клетки губчатой паренхимы занимают значительную часть листовой пластинки, расположены рыхло, между ними формируются крупные межклетники диаметром до 230.8±7.2 мкм. Длина (59.5±1.9 мкм) и ширина (39.4±0.8 мкм) клеток аэренхимы почти в 1,5 раза меньше размеров клеток этой ткани в вегетативном столоне.
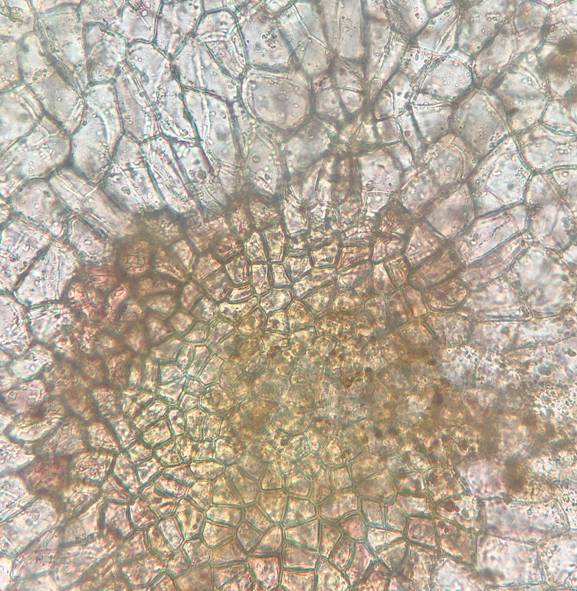
Рис. 6. Гидропоты на нижней стороне листа Nymphoides peltata (увеличение 10х).
Воздухоносные полости аэренхимы способствуют плавучести листьев, которые сохраняют форму пластинки и положение в пространстве без сильного развития механических тканей, которые у N. peltata представлены отдельными астросклереидами длиной 503.7±9.3 мкм в губчатой паренхиме (рис. 7).
L. N. Willey (2012) считает, что немногочисленные и небольших размеров склереиды являются признаком увядающих листьев видов рода Nymphoides Seg. Однако по данным проведенного нами исследования астросклереиды в листьях малочисленные и отличаются наибольшими размерами по сравнению со склереидами в других вегетативных органах изучаемого вида. Аналогичные различия в размерах астросклереид, образующихся в вегетативных органах N. peltata, установлены Săndulescu с соавторами (Săndulescu et al., 2016). При этом значения размеров астросклереид в листьях изучаемого вида, произрастающего в Архангельской области России, ниже, чем в листьях (576 мкм, 720 мкм) у растений, обитающих в водоемах с разными физико-химическими параметрами воды в Румынии (Săndulescu et al., 2016).

Рис. 7. Астросклереиды в листе Nymphoides peltata.
Клетки однослойной эпидермы черешков листьев вытянутой формы, первичная кора сложена клетками прямоугольной формы, расположенными в два ряда. Аэренхима состоит из крупных клеток и межклетников, при этом воздухоносные полости разного размера. Более крупные по диаметру (603.0±25.4 мкм) межклетники располагаются в центральной части черешка, меньшие (351.6±19.6 мкм) ближе к клеткам коры. Наличие воздушных полостей в черешках обеспечивает, как и в листьях, плавучесть растения. Длина (72.2±2.0 мкм) и ширина (54.6±1.2 мкм) клеток аэренхимы незначительно меньше размеров клеток этой ткани в вегетативном столоне и в придаточных корнях, но существенно больше, чем в корневище и листьях.
Механическая ткань представлена немногочисленными астросклереидами длиной 340.0±12.5 мкм, расположенными между воздухоносными камерами, и клетками склеренхимы, окружающими коллатеральные проводящие пучки. Вокруг пучков также образуется слой овальных клеток эндодермы. Проводящий пучок в центральной части черешка в 2 раза крупнее двух других пучков.
Столоны-цветоносы
Столоны-цветоносы диаметром до 5 мм несут придаточные корни, листья и соцветия. Придаточные корни на них, также как и на вегетативных столонах, в отличие от придаточных корней на корневище, тонкие с многочисленными разветвлениями, количество их обычно 3–4. На столонах-цветоносах формируется от 4 до 7 листьев, в соцветии 3–4 цветка. Цветение N. peltata в изучаемом местообитании обильное и продолжительное (до конца августа – начала сентября). Цветок у этого вида со слабым сладким запахом, распускается всего на 1 день и к вечеру увядает (Van Der Velde, Van Der Heijden, 1981). Цветки раскрываются последовательно, но и количество одновременно фиксируемых цветков довольно большое на площадь, занимаемую популяцией. Если в первой декаде августа отмечается 30–60 цветков, то в конце месяца количество цветков в популяции составляет несколько сотен (400–500 шт.). Леднев (2015) отмечает, что в течение второго сезона рост вегетативного столона завершается, как и у столона-цветоноса, образованием соцветия. Возможно, с этим связано существенное увеличение числа цветков в конце августа.
Размножение N. peltata в изучаемом местообитании происходит в основном вегетативным путем. Вид характеризуется большим потенциалом для захвата больших площадей, вытесняя другие виды, в течение одного вегетационного периода посредством вегетативного размножения (Brock et al., 1983). Из одного растения может развиться более 100 новых особей всего за 12 недель (Zhonghua et al., 2007). Некоторые исследователи отмечают высокую семенную продуктивность у этого вида, более 3000 семян на 1 м², которые вначале плавают на поверхности воды, а затем опускаются в грунт на дно водоема (Van Der Velde, Van Der Heijden, 1981; Huang et al., 2015).
Наши наблюдения показали, что в данном местообитании происходит втягивание формирующихся плодов под воду и плоды созревают под водой. Плавающих на поверхности воды семян обнаружено не было.
Вероятно у растений N. peltata, произрастающих на границе своего распространения в северной части ареала, семена не успевают созревать. Кроме того, Леднев (2015) указывает на то, что данный вид обладает дистилией, которая эволюционирует в настоящую двудомность. В мономорфных популяциях семенное размножение отсутствует, и популяция самоподдерживается за счет клонального роста; в диморфных популяциях отмечено семенное размножение (Wang et al., 2005). По мнению Леднева (2015) чаще встречаются диморфные популяции N. peltata. Изучаемая нами популяция является мономорфной, возможно потому, что находится на границе ареала.
В целом анатомическое строение столонов-цветоносов сходно с анатомией вегетативных столонов и черешков листьев, отличие заключается только в более плотном расположении межклетников и меньшим их диаметром (377.4±21.7 мкм).
Большой объем аэренхимы со значительным количеством астросклереидов в побегах и элементах цветка N. рeltata отмечают и другие исследователи (Săndulescu et al., 2016). Необходимо отметить, что в листьях наиболее крупные по размерам астросклереиды, а наименьшие в корневище. Черешки листьев и вегетативные столоны отличаются наибольшими по диаметру межклетниками. М. Khatun and A. K. Mondai (2011) отмечают, что различная морфология (форма и размеры) астросклереидов в вегетативных и генеративных органах имеет таксономическое значение для определения видов рода Nymphoides Seg.
Заключение
Проведенное исследование показало, что популяция вида N. рeltata активно развивается, но освоение территории происходит не так быстро, как это отмечается в более южных местообитаниях (Brock et al., 1983; Cook, 1985; Huang et al., 2015; Săndulescu et al., 2016). Возможно, это связано с меньшей продолжительностью вегетационного сезона в районе произрастания, позднего освобождения от весеннего заливания, более низкими температурами и гидрологическими особенностями.
В наших исследованиях экотоп, который занимает N. рeltata - мелководье, которое образуется из-за смены русла реки Северная Двина и ее обмеления. Занятая видом территория имеет глубину до 70 см и слабый водоток и за ее пределы, в сторону больших глубин и более высокой скорости течения, вид не распространяется, а осваивает новые территории вдоль берега по течению. Популяция нормальная, полночленная, саморазвитие происходит в основном за счет омоложения ежегодно формирующимися вегетативными столонами. В годы наблюдений цветение растений было обильным и продолжительным, образование новых цветков отмечалось еще в конце августа – начале сентября, что приводило к увеличению их числа. Семенная продуктивность невысокая и в отличие от южных местообитаний вида (Van Der Velde, Van Der Heijden, 1981; Huang et al., 2015) в районе исследования все семена не успевают созревать, что возможно ограничивается низкими температурами воды.
Анатомическими признаками вида является значительное развитие аэренхимы и астросклереидов, что обеспечивает механическую поддержку растений и защитную функцию в водной среде. Однако особенностями N. рeltata в данных условиях обитания являются отсутствие астросклереидов в придаточных корнях и их значительно меньшее присутствие в других вегетативных органах растения в отличие от литературных данных по этому виду, произрастающему в местообитаниях в южной части ареала (Mehrvarz, Nodehi, 2016; Săndulescu et al., 2016). Возможно, это связано с поддержанием не только механической прочности разных органов и особенно корней, но и необходимостью поддержания высокой степени лабильности органов в условиях нестабильного уровня движущейся воды. Уменьшение слоев палисадной паренхимы (2 ряда и 3-4 ряда у растений в стоячих водоемах) (Săndulescu et al., 2016) и хорошо развитый губчатый мезофилл с межклетниками свидетельствует о светолюбии вида в этих условиях и высокой ассимиляционной активности. Выявлено, что растения N. рeltata, произрастающие на северной границе ареала, формируют мощный ассимиляционный аппарат, который на третий год существования значительно перекрывает водную поверхность, активно накапливают запасное вещество инулин, которое идентифицировалось в разных тканях корневища.
Таким образом, можно предположить, что выявленные отличия морфологических и анатомических характеристик вегетативных органов N. рeltata свидетельствуют о высокой степени адаптации вида к условиям прибрежных местообитаний вдоль р. Северная Двина на границе своего ареала.
Литература
Губанов И. А., Киселева К. В., Новиков В. С., Тихомиров В. Н. Иллюстрированный определитель растений Средней России. Том 3: Покрытосеменные (двудольные: раздельнолепестные). М.: Товарищество научных изданий КМК, Институт технологических исследований, 2004. 520 с.
Леднев С. А. Биоморфология и сезонное развитие Nymphoides peltata (Gmel.) O. Kuntze // Бюллетень Московского общества испытателей природы. Отделение Биология. 2015. Т. 120. Вып. 1. С. 69—75.
Флора северо-востока Европейской части СССР. Т. IV. Л.: Наука, 1977. 312 с.
Фурст Г. Г. Методы анатомо-гистохимического исследования растительных тканей. М.: Наука, 1979. 155 с.
Brock Th. C. M., Arts G. H. P., Goossen I. L. M., Rutenfrans A. H. M. Structure and annual biomass production of Nymphoides peltata (Gmel.) O. Kuntze (Menyanthaceae) // Aquatic Botany. 1983. № 17. P. 167—188.
Champion P. D., Clayton J. S. The evaluation and management of aquatic weeds in New Zealand // Plant Invasions: Ecological Threats and Management Solutions. Backhuys. 2003. P. 429—434.
Cook C. D. K. Range extension of aquatic vascular plant species // J. of Aquatic Plant Management. 1985. № 23. P. 1—6.
Darbyshire S. J., Francis A. The biology of invasive alien plants in Canada. 10. Nymphoides peltata (S. G. Gmel.) Kuntze // Can. J. Plant Sci. 2008. Vol. 88. P. 811—829.
Huang W., Chen Q., Chen K. Seed bank characteristics of the Nymphoides peltata population in Lake Taihu // Sci. Rep. . 2015. Vol. 5. 8 p.; URL: http://www.nature.com/articles/srep13261. DOI: 10.1038/srep13261 .
Khatun M., Mondal A. K. Studies on the sclereids diversity and distribution pattern in the different plant organs (leaves, stems and fruits) of some selected medicinally viable angiospermic taxa in Eastern India: a systematic approach // Adv. Biores. 2011. Vol. 2 (1). Р. 111—121.
Krausch H. D. Vegetationskundliche Beobachtungen in Donaudelta. Limnologica. 1965. Bd. 3. Hf 3. S. 271—313.
Li Z., Yu D., Xu J. Adaptation to water level variation: Responses of a floating-leaved macrophyte Nymphoides peltata to terrestrial habitats // Ann. Limnol. Int. J. Lim. 2011. Vol. 47. Р. 97—102.
Mehrvarz S. S., Nodehi M. A. A review of the genus Nymphoides (Menyanthaceae) in Iran // Phytotaxa. 2016. Vol. 257. No 3. Р. 261—270; URL: http://dx.doi.org/10.11646/phytotaxa.257.3.4 .
Nedelcu G. A. Flora si vegetatia acvatică si palustră a cîtorva lacuri din Cîmpia Românăcu unele consideratii morfologice. Bucuresti: Ed. Acad. R. S. R. 1969. 232 p.
Săndulescu E. B., Vasile Scăeţeanu G., Şchiopu T., Oltenacu N., Stavrescu-Bedivan M.—M. Morpho-anatomy and adaptation to some Romanian aquatic environments of Nymphoides peltata (Gmel.) O. Kuntze (Asterales: Menyanthaceae) // Scientific Papers. University of Agronomic Sciences and Veterinary Medicine of Bucharest. Romania. Series A. Agronomy. 2016. Vol. LIX. P. 537—542.
Seago Jr. J., Marsh L., Stevens K., Soukup A., Votrubova O., Enstone D. A re-examination of the root cortex in wetland flowering plants with respect to aerenchyma // Annals of Botany. 2005. Vol. 96. Р. 565—579.
Smith A. J. M., De Lyon M. J. H., Van Der Velde G., Steentjes P. L. M., Roefols J. G. M. Distribution of three nymphaeid macrophytes (Nymphaea alba L., Nuphar lutea (L.) Sm. and Nymphoides peltata (Gmel.) O. Kuntze) in relation to alkalinity and uptake of inorganic carbon // Aquatic Botany. 1988. № 32. P. 45—62.
Van Der Velde G., Van Der Heijden L. A. The floral biology and seed production of Nymphoides peltata (Gmel.) O. Kuntze (Menyanthaceae) // Aquatic Botany. 1981. Vol. 10. P. 261—293.
Wang Y., Wang Q.-F., Guo Y.-H., Barrett S. C. H. Reproductive onsequences of interactions between clonal growth and sexual reproduction in Nymphoides peltata: a distylous aquatic plant // New Phytologist. 2005. № 165. P. 329—336.
Willey L. N. Biology and control of the invasive aquatic plant crested floating heart (Nymphoides cristata). Msc. Thesis . 2012. 109 p.; URL: http://ufdc.ufl.edu/ufe0045143/00001 .
Wu Z., Yu D., Tu M., Wang J., Li Z. Competitive erformance of Nymphoides peltata (Gmel.) O. Kuntze growing in microcosm // Ydrobiologia. 2006. № 571. P. 41—49.
Zhonghua W., Dan Y., Manghui T., Qiang W., Wen X. Interference between two floatingleaved aquatic plants: Nymphoides peltata and Trapa bispinosa // Aquatic Botany. 2007. Vol. 86. Р. 316—320.





