Введение
Ввиду высокой антропогенной нагрузки и наличию широкого обилия растений в иных от условия естественного произрастания ‒ ботанические сады являются уязвимыми к проникновению различных инвайдеров (возбудителей болезней растений и насекомых вредителей) (Каштанова и др., 2018). Ксилофильные жесткокрылые обеспечивают процессы деструкции ослабленных и поваленных деревьев. Среди них есть виды, дающие массовые вспышки, приводящие к очагам поражения жизнеспособных деревьев. Кроме того, короеды связаны с эндопаразитическими нематодами, что может вызывать вилт хвойных и лиственных пород (Полянина и др., 2019). Короеды являются переносчиками большого числа офиостомовых грибов, которые способствуют угнетению деревьев. Например, в ходах короеда типографа частота встречаемости офиостомовых грибов для ели сибирской составляет 97-100 % (Пашенова, Баранчиков, 2015).
Феромониторинг успешно используют в научных целях для изучения опасных и карантинных насекомых: коричневый мраморный клоп (Leskey et al., 2021), каштановая моль (Камаев, Тодоров, 2014), короеды (Сагитов и др., 2017; Šramel et al., 2021). Феромониторинг позволяет исследовать активность вредителей, которую можно использовать для прогноза и проведения мероприятий по защите леса (Чалкин и др., 2021).
Целью работы является проведение феромониторинга основных видов ксилофильных жесткокрылых: короеда-типограф Ips typograthus (Linnaeus, 1758), гравера обыкновенного Pityogenes chalcographus (Linnaeus, 1761) и усачей рода Monochamus (Dejean, 1821).
Объекты и методы исследований
Исследование проводили в вегетационный период в течении четырех лет (2018‒2021 гг.) Для феромониторинга ксилофильных жесткокрылых были применены комплекты ловушек производства ФГБУ «ВНИИКР». По три ловушки барьерно-вороночного типа устанавливали в двух типах биоценозах: сосняк черничный и елово - сосновый травяно-черничный (рис. 1.).
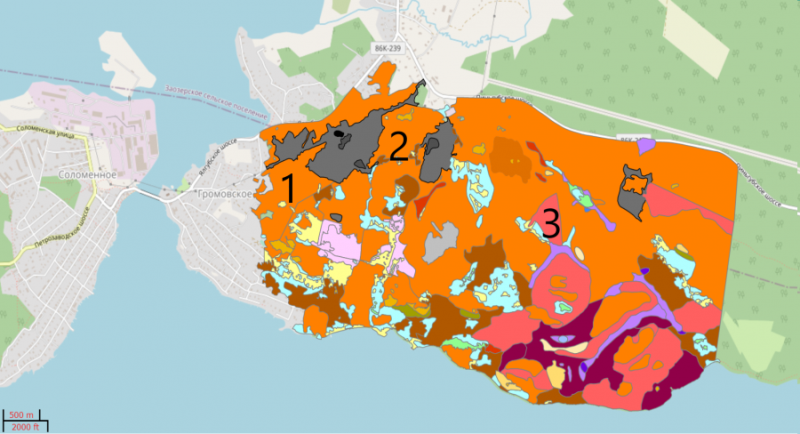
Рис. 1. Места установки феромонных ловушек на исследуемой территории: 1 и 2 – сосняк черничный; 3 – елово-сосновый травяно-черничный (карта природной растительности сетевого атласа Ботанического сада ПетрГУ https://garden.karelia.ru/atlas/atlas.xml).
Комплекты ловушек барьерно-вороночного типа включают в себя корпус черного цвета высотой 600 мм, диаметром 220 мм и диспенсер, который крепится на крестообразную пластину с нанесенным аттрактантом. Снизу ловушки подвешивается воронка с накопительной емкостью (стакан 200-500 мл).
В работе использовались синтетические аттрактанты производства ФГБУ «ВНИИКР» для трех видов ксилофильных жесткокрылых: короед-типограф (I. typograthus), гравер обыкновенный (P. chalcographus) и усачи рода Monochamus. Состав каждого аттрактанта индивидуален. В основе трехкомпонентной смеси короеда типографа включен ипсдиенол, для однокомпонентного аттрактанта гравёра – халькогран, а у шестикомпонентной смеси усачей рода Monochamus - монохамол (Чалкин и др., 2021; Лябзина и др., 2022).
В среднем аттрактанты способны привлекать насекомых в ловушку в течение 30 суток, охватывая площадь в ⁓ 1 га. Однако во влажный период рекомендуется производить замену диспенсера 2 раза в месяц. Выемку и учёт отловленного энтомологического материала проводили каждые 5‒7 дней. По данным Атанова М. Н. и Кузина А. А (2018) такая периодичность сбора является оптимальной для ловушек данного типа и не позволяет материалу загнивать и привлекать жуков-некрофагов.
Характеризуя сообщества ксилофильных жесткокрылых применяли индексы разнообразия Шенона H', Симпсона C и Бергера Паркера d (Шитиков, Розенберг, 2005). Графики видового разнообразия построены в программе Past 3.4 (Hammer et al., 2001).
Результаты и обсуждение
В феромонные ловушки было отловлено 17 видов жесткокрылых из 8 семейств (табл. 1). Фауна ксилофильных жесткокрылых в Ботаническом саду ПетрГУ представлена типичными видами, характерными для таежных биоценозов. Наиболее многочисленно в видовом и количественном составах представлено семейство короеды (Scolytidae) – 7 видов. Среди них к многочисленным видам относятся Crypturgus pusillus, Hylurgops palliatus, Ips typographus, и Pityogenes chalcographus. Эти виды входят в ядро ксилофильного энтомокомплекса Северо-западных районах (Мозолевская, Шарапа, 1996; Мандельштам, Селиховкин, 2020). В саду эти виды активно наносят повреждения хвойным породам в естественных насаждениях (рис. 2). На интродуцированных растений родов Abies Mill., Juniperus L., Larix Mill. вредителей не регистрировали.
В течении всего периода сбора количественные показатели отлова изучаемых жесткокрылых изменялись незначительно (рис. 3). Это свидетельствует о том, что на территории отсутствуют вспышки опасных вредителей. По многолетним данным растительность биоценозов Ботанического сада ПетрГУ обладает богатым разнообразием и пригодна для изучения, как модель формирования растительного покрова (Платонова, Лантратова, 2001).
В ловушках с используемыми аттрактантами в сборах целевой вид составляет 70 % (табл. 1). Остальная часть представлена другими ксилобионтами (пестряки, долгоносики, блестнянки, притворяшки и др.), которых, вероятно, привлекает обилие доступной пищи. Различие в уловистости ловушек каждого типа подтверждает видоспецифичность применяемых аттрактантов, что важно для сохранения биоразнообразия при проведении феромониторинга и отлова целевых объектов. Так, феромонные ловушки Monochamus spp. фиксировали только имаго этих насекомых и лишь единичные случаи попадания в накопительные емкости особей жуков‒короедов (Scolytidae).
| A |  |
 |
| B |  |
 |
| C |  |
 |
| D |  |
 |
Рис. 2. Ксилофильные жесткокрылые Ботанического сада ПетрГУ: А ‒ самка большого черного елового усача Monochamus sartor urussovii и личиночные ходы в древесине ели; B ‒ короед-типограф (Ips typographus), маточные и личиночные ходы на коре ели; C ‒ самка гравера обыкновенного (Pityogenes chalcographus), маточные и личиночные ходы на коре сосны; D ‒ малый еловый лубоед, фиолетовый лубоед (Hylurgops palliatus), маточныей и личиночные ходы на коре сосны.
Таблица 1. Ксилофильные жесткокрылые, отловленные феромонными ловушками в различных ценозах Ботсада ПетрГУ
| Систематическое положение | Аттрактант | Кол-во отловленных экземпляров, шт. | |
| Елово-сосновый травяно-черничный | Сосняк черничный | ||
| Сем. Cleridae | |||
| Thanasimus formicarius (Linnaeus, 1758) | Т, Г | 50 | 51 |
| Сем. Nitidulidae | |||
| Cychramus variegatus (Herbst, 1792) | Т, Г | 4 | 0 |
| Сем. Cerambycidae | |||
| Monochamus galloprovincialis (Oliv., 1795) | У | 4 | 2 |
| M. sartor urussovii (Fischer von Waldheim, 1806) | У | 5 | 2 |
| M. sutor (Linnaeus, 1758) | У | 13 | 6 |
| Сем. Curculionidae | |||
| Pissodes notatus (Germar, 1817) | Т, Г | 6 | 27 |
| Hylobius abietis (Linnaeus, 1758) | Т, Г | 1 | 18 |
| Сем. Peltidae | |||
| Peltis grossa (Linnaeus, 1758) | Т, Г | 0 | 4 |
| Сем. Scolytidae | |||
| Crypturgus pusillus (Gyllenhal, 1813) | Т, Г | 63 | 11 |
| Hylastes brunneus (Erichson, 1836) | Т | 14 | 25 |
| Hylurgops palliatus (Gyllenhal, 1813) | Т, Г | 31 | 29 |
| Ips typographus (Linnaeus, 1758) | Т, Г, У | 157 | 41 |
| Pityogenes chalcographus (Linnaeus, 1761) | Т, Г, У | 354 | 163 |
| Tomicus minor (Linnaeus, 1758) | Г | 0 | 7 |
| Tomicus piniperda (Linnaeus, 1758) | Г | 4 | 7 |
| Сем. Ostomatidae | |||
| Ostoma ferruginea (Linnaeus, 1758) | Т, Г | 7 | 8 |
| Сем. Ptinidae | |||
| Anobium punctatum (De Geer, 1774) | Т, Г | 1 | 2 |
| Всего количество видов, S | 14 | 15 | |
| Всего количество особей, N | 714 | 403 | |
Примечание: Т – Ips typographus; Г – Pityogenes chalcographus; У – Monochamus spp.
В течение весенне-летнего периода количество отловленных особей гравера обыкновенного и типографа в изучаемых биоценозах вблизи ботсада различалось. Основная доля жуков попадалась в конце июня начале июля, что связано с их сезонной динамикой лёта. Для короеда-типографа и гравера обыкновенного в Карелии установлена однофазная активность и максимальное их количество регистрируется в июне (гравера – 5000 особей/ловушку, короеда – 700 особей/ловушку), а в августе наблюдается постепенное снижение численности (Чалкин и др., 2021).
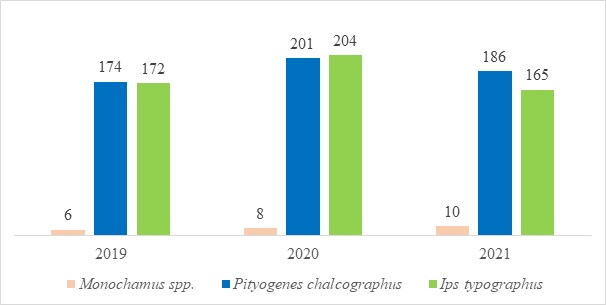
Рис. 3. Динамика отлова ксилофильных насекомых феромонными аттрактантами (Ips typographus, Pityogenes chalcographus, Monochamus spp.) за период 2019-2021 гг., шт.
Усачи рода Monochamus попадаются спорадически, а их невысокая плотность является хорошим показателем здоровья изученных биоценозов. Известно, что количество отловленных имаго менее 20 особей на один диспенсер является признаком популяцией с низкой численностью и подтверждает факт отсутствия очага размножения этих вредителей (Комарова, 2015). Серьезное повреждение наносят их личинки, выгрызая в коре стволов глубокие ходы (рис. 2). Это приводит к усыханию деревьев и снижению технического качества древесины.
Все отмеченные виды рода Monochamus включены в список карантинных объектов, ограниченно распространенных на территории Российской Федерации (Национальный доклад, 2020). Жуки являются как переносчиками, так и хозяевами сосновой стволовой нематоды Bursaphelenchus xylophilus (Steiner, Buhrer, 1934; Nickle, 1970). Гельминты попадают в древесину во время питания усачей и быстро распространяются, что приводит к закупорки проводящей системы. В Карелии произрастают восприимчивые к этому патогену хвойные породы (ель, сосна). Можно предположить, что B. xylophilus способен выжить, но климатические условия региона на большей территории не благоприятны для его интенсивного развития (Чалкин и др., 2022).
Феромонными ловушками отловлен близкий видовой состав ксилофильных жесткокрылых в изучаемых биоценозах (рис. 4). Сходство связано с экологической пластичностью большинства ксилобионтов, обитающих на хвойных растениях. Отличия связаны с регистрацией небольшого числа особей малого лесного садовника (Tomicus minor Linnaeus, 1758) в сосняке (табл. 1). Однако и эти жуки могут встречаться в ельнике.
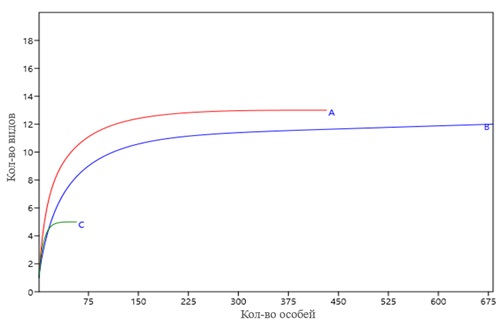
Рис. 4. Видовое богатство ксилофильных жесткокрылых отловленных ловушками на аттрактанты: А – Ips typographus, В – Pityogenes chalcographus, С – Monochamus spp.
Различия по отлову феромонными ловушками связаны с количественным сбором особей. В ельнике-сосновом травяно-черничном биоценозе количество собранных особей в два раза выше чем в сосняке черничном и отмечено наибольшее число представителей семейства короеды (Scolytidae) (рис. 5). Типичными видами являются: короед крошка Crypturgus pusillus, фиолетовый лубоед Hylurgops palliates, короед-типограф I. typograthus, гравёр обыкновенный P. chalcographus, напротив, в сосняках на феромонные ловушки больше отловлено представителей семейства долгоносики (Curculionidae) (рис. 5).
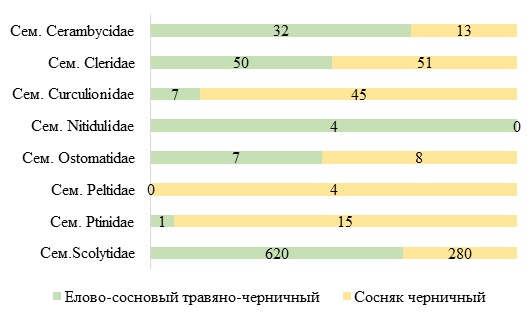
Рис. 5. Количественное соотношение особей разных семейств, отловленных в изучаемых биоценозах.
Таблица 2. Индексы разнообразия сообщества ксилобионтов отловленные разными аттрактантами в хвойных ценозах Ботсада ПетрГУ
| Индекс | Аттрактанты | |||||
| Елово-сосновый травяно-черничный | Сосняк черничный | |||||
| I. typograthus | P. chalcographus | Monochamus spp. | I. typograthus | P. chalcographus | Monochamus spp. | |
| Шеннона, H' | 1.7 | 0.9 | 0.8 | 2.0 | 1.6 | 1.0 |
| Симпсона, C | 0.75 | 0.38 | 0.45 | 0.84 | 0.62 | 0.59 |
| Бергера – Паркера, d | 0.43 | 0.39 | 0.72 | 0.23 | 0.4 | 0.54 |
| Кол-во видов, S | 10 | 9 | 5 | 10 | 12 | 3 |
| Кол-во особей | 289 | 393 | 14 | 140 | 250 | 10 |
Заключение
Ландшафтные парки, дендропарки и ботанические сады занимают промежуточное положение, их экологические условия близки к условиям лесопарков. Фауна здесь разнообразна и состоит как из типично городских видов, так и из целого рядя лесных представителей. В таких насаждениях вспышки массового размножения вредителей бывают редко ввиду их низкой численности и своевременного ухода за лесопосадками. Синтетические феромоны позволяют в естественных условиях определить группы определенных видов насекомых. Изучение хозяйственно важных видов насекомых вредителей показало, что феромоны являются специфичными для каждого вида. Эта специфичность особенно важна для сохранения полезных видов в ценозах. Побочным образом в накопительных емкостях ловушек собираются различные виды насекомых, которые могли попасть в ловушку случайно или быть привлечены продуктами гниения. Систематическое вывешивание феромонных ловушек позволяет произвести отлов насекомых-верителей для учета их численности и принятия решений о проведении мероприятий по защите биоценоза.
Литература
Атанов Н. М., Кузин А. А. К вопросу об испытании аттрактивности феромонов насекомых в полевых условиях // Защита и карантин растений. 2018. № 6. С. 38—41.
Вендило Н. В., Плетнев В. А., Серая Л. Г., Черменская Т. Д., Комарова И. А., Хегай И. В., Петрова М. О., Степанычева Е. А. Полевые испытания привлекающих смесей для гравера обыкновенного Pityogenes chalcographus (L.) // Мониторинг и биологические методы контроля вредителей и патогенов древесных растений: от теории к практике. 2016. С. 52—53.
Вендило Н. В., Серая Л. Г. Применение феромонов для мониторинга вредителей на территории ГБС РАН // Бюллетень Главного ботанического сада. 2019. № 1. С. 45.
Гниненко Ю. И., Хегай И. В. Муравьежук - важный энтомофаг короеда-типографа // Защита и карантин растений. 2016. № 4. С. 46—48.
Гниненко Ю. И., Хегай И. В., Чилахсаева Е. А. Технология мелкосерийного производства муравьежука Thanasimus sp. для использования в защите леса. Пушкино: ВНИИЛМ, 2016. С. 16.
Камаев И. О., Тодоров Н. Г. Исследование эффективности синтетического феромона и феромонных ловушек для каштановой моли (Cameraria ohridella Deschka et Dimic, 1986) в Московской области // Карантин растений. Наука и практика. 2014. № 1. С. 52—55.
Каштанова О. А., Мухина Л. Н., Серая Л. Г., Дымович А. В., Тихонюк В. А., Ткаченко О. Б. Вспышка короеда-типографа на коллекции ели в Главном ботаническом саду РАН // Бюллетень Главного ботанического сада. 2018. № 1. С. 65—71.
Комарова И. А. Критерии угрозы массовых размножений вредных насекомых по данным феромонного надзора // Чтения памяти Андрея Игнатьевича Ильинского: сб. докладов / Отв. редактор Ю. И. Гниненко. 2018. С. 25.
Крутов В. И., Шубин В. И., Предтеченская О. О., Руоколайнен А. В., Коткова В. М., Полевой А. В., Хумала А. Э., Яковлев Е. Б.
Грибы и насекомые-консорты лесообразующих древесных пород Карелии / Отв. ред. А. В. Полевой. Петрозаводск: Карельский научный центр РАН, 2014. 216 с.
Лябзина С. Н., Чалкин А. А., Синицына Е. B., Синкевич О. В., Донской О. А. Феромониторинг жуков-усачей рода Monochamus в различных особо охраняемых природных территориях Республики Карелия // Фитосанитария. Карантин растений. 2022. № 1. С. 48—55.
Мандельштам М. Ю., Селиховкин А. В. Короеды Северо-Запада России (Coleoptera, Curculionidae: Scolytinae): история изучения, состав и генезис фауны // Энтомологическое обозрение. 2020. Т. 99. № 3. С. 631—665.
Мозолевская Е. Г., Шарапа Т. В. Видовой состав насекомых-ксилофагов Мурманской области // Энтомологическое обозрение. 1996. Т. 75. № 3. С. 558—566.
Национальный доклад о карантинном фитосанитарном состоянии территории Российской Федерации в 2020 году // Защита и карантин растений. 2021. № 7. С. 3—16.
Никитский Н. Б. Жуки-ксилофаги – вредители древесных растений России. М.: Изд-во Лесная промышленность, 2005. 120 с.
Пашенова Н. В., Баранчиков Ю. Н. Связь офиостомовых грибов с насекомыми-ксилофагами в хвойных лесах // Материалы VII Всероссийской микологической школы-конференции с международным участием «Биотические связи грибов: мосты между царствами»: Сборник докладов и тезисов, 2015. С. 187.
Петров А. В., Доставалов Е. А. Изменение агрессивности короедов (Coleoptera: Curculionidae: Scolytinae), ассоциированных с патогенными микроорганизмами // Известия Санкт-Петербургской лесотехнической академии. 2015. № 211. С. 76—91.
Платонова Е. А., Лантратова А. С. Разнообразие растительного покрова заповедной территории Ботанического сада ПетрГУ // Hortus botanicus. 2001. Т. 1. С. 42—51.
Полянина К. С., Мандельштам М. Ю., Рысс А. Ю. Краткий обзор ассоциаций ксилобионтных нематод с жуками-короедами (Coleoptera, Curculionidae: Scolytinae) // Энтомологическое обозрение. 2019. Т. 98. № 3. С. 481—499.
Сагитов А. О., Ашикбаев Н. Ж., Мухамадиев Н. С., Мендибаева Ж. Феромонные ловушки против короедов (Scolytidae) в Заилийском Алатау // Защита и карантин растений. 2017. № 10. С. 47.
Селиховкин А. В., Марковская С., Васайтис Р., Мартынов А. Н., Мусолин Д. Л. Фитопатогенный гриб Fusarium circinatum и возможности его распространения насекомыми в России // Российский журнал биологических инвазий. 2018. Т. 11. № 2. С. 53—63.
Степанычева Е. А., Петрова М. О., Черменская Т. Д., Вендило Н. В. Сравнительная оценка активности феромонов для короеда-типографа Ips typographus (L.) (Coleoptera, Scolytidae) и способов их применения //Энтомологическое обозрение. 2017. Т. 96. № 2. С. 213—219.
Чалкин А. А., Лябзина С. Н., Синицына Е. В., Лобур А. Ю., Донской О. А. Мониторинг жуков короедов (Scolytinae) в лесных ценозах заповедника "Кивач" с помощью феромонных ловушек отечественного производства // Лесной вестник. 2021. Т. 25. № 6. С. 98—105. DOI: 10.18698/2542-1468-2021-6-98-105.
Чалкин А. А., Кулинич О. А., Арбузова Е. Н., Рысс А. Ю. Сосновая стволовая нематода Bursaphelenchus xylophilus (Steiner & Buhrer) Nickle и возможности ее акклиматизации в Республике Карелия // Труды Карельского научного центра РАН. 2022. № 1. С. 63—76. DOI: 10.17076/bg1512.
Шитиков В. К., Розенберг Г. С. Оценка биоразнообразия: попытка формального обобщения // Количественные методы экологии и гидробиологии: сборник научных трудов, посвященный памяти А. И. Баканова. Тольятти: СамНЦ РАН, 2005. С. 91—129.
Яковлев Е. Б., Полевой А. В., Хумала А. Э. Энтомофауна заказника Кижские шхеры. Острова Кижского архипелага. Биогеографическая характеристика // Труды Карельского научного центра Российской академии наук. 1999. № 1. С. 87—90.
Hammer Ø., Harper D. A. T., Ryan P. D. PAST: Paleontological statistics software package for education and data analysis // Palaeontologia Electronica. 2001. Vol. 4 (1). P. 9.
Leskey T. C. Andrews, H., Bády, A., Benvenuto, L., Bernardinelli, I., Blaauw, B., Wiman, N. Refining Pheromone Lures for the Invasive Halyomorpha halys (Hemiptera: Pentatomidae) Through Collaborative Trials in the United States and Europe // Journal of economic entomology. 2021. Vol. 114. № 4. P. 1666—1673. DOI: 10.1093/jee/toab088.
Šramel N., Kavčič A., Kolšek M., De Groot M. Estimating the most effective and economical pheromone for monitoring the European spruce bark beetle // Journal of Applied Entomology. 2021. Vol. 145. № 4. P. 312—325. DOI:10.1111/jen.12853.





