Введение
Эфирные масла используются в разных отраслях промышленности, в научных и коммерческих целях. Их используют во многих областях: косметология, медицина, пищевая промышленность, ароматерапия, традиционная терапия и фитотерапия (Работягов и др., 2007).
Мирт обыкновенный (Myrtus communis L., семейство Myrtaceae) представляет значительный интерес как ценное лекарственное, пряно-ароматическое растение для региона – полуостров Апшерон (Азербайджан) (Абасова и др., 2009). Kультивируется как декоративное растение и источник эфирных масел, содержащихся во всех органах (Ozek et al., 2000). На Апшерон в Мардаканский дендрарий был интродуцирован в 1960 году из Никитского ботанического сада (Агамиров, 2002).
Азербайджан по природно-климатическим условиям сходен со многими регионами Средиземноморья. Листья и плоды этого вида традиционно используют в качестве дезинфицирующего и гипогликемического средства (Elfellah et al., 1984), отвар листьев – жидкость для полоскания рта, для лечения кандидоза, для заживления ран, а также в терапии заболеваний мочевыводящих путей (Mansouri et al., 2001; Cakir, 2004). Отмечается, что настойка мирта никаких осложнений и отрицательных побочных действий на организм не оказывает (Jinous et al., 2015). Эфирное масло мирта является ценным сырьём для косметической и пищевой промышленности (Bouzouita et al., 2003; Yadegarinia et al., 2006). Листья добавляют в жареное мясо, начинки, салаты и мясные рагу (Машанов, Покровский, 1991).

Рис. 1. Myrtus communis L. с цветками и плодами. |

|
Цель настоящей работы – установление компонентного состава эфирного масла Myrtus communis L. из растительного сырья, выращиваемого на полуострове Апшерон Республики Азербайджан.
Объекты и методы исследований
Апшерон характеризуется сухим субтропическим климатом. Средняя годовая температура около 12 – 15 °C, абсолютный минимум температур зимой +2 - +4 °C, максимум летом +36 – +38 °C; переход среднесуточной температуры выше 4 °C происходит в первой-второй декаде марта. Период с устойчивыми среднесуточными температурами воздуха ниже 0 °C наблюдается крайне редко. Количество осадков – до 560 мм (Мамедов, 2010).
Исследования проводили в 2021 г. в лаборатории эфирномасличных растений. Объектом исследования было сырье мирта обыкновенного, собранное от растений, выращенных в коллекционном питомнике дендрария НАН Азербайджана (пос. Мардакан, Хазарский район, Республика Азербайджан).
Мирт обыкновенный – M. communis L. вечнозеленый многолетний кустарник до 3 м высоты, крона густая, многоветвистая; молодые побеги четырёхгранные, зеленовато-серые; 2-3-летние побеги округлые или слабо граненые, серые или серо-коричневатые. Листья железчатые супротивные, от яйцевидных до ланцетных, 2-5 см длиной, 1-2,5 см шириной, заостренные, цельнокрайние, кожистые, при растирании душистые. Цветки белые, расположены по одному на коротких цветоножках. Цветет в конце мая - июне. Плод - синевато-черный (иногда белый), многосеменная ягода, 10-12 мм длиной и 5-6 мм шириной (рис. 1). В каждом плоде 5-15 семян. Плоды выглядят, как круглые белые ягоды, имеют пряный сладковатый вкус и созревают в ноябре - декабре (Мамедов, 2010). Произрастает в субтропических странах: Южной Европе, Южной Америке, Северной Африке, северо-западной Индии, средиземноморском районе Австралии и Западной Азии (Мамедов, 1985).
Эфирное масло из измельченного свежесобранного растительного сырья получали методом гидродистилляции по способу, описанному в 11 ГФ СССР (11-е изд) (Гос. фарм., 1987), а определение содержания эфирного масла в лабораторных условиях проводили по Клевенджеру (Jennings, 1980). Все растения находились в генеративном состоянии (4-й год жизни).
Существующие технологии переработки эфирномасличного сырья предусматривают его подготовку. Для этого используют разные методы: измельчение, подвяливание, высушивание, ферментацию, обработку ультразвуком, инфракрасными лучами. В наших исследованиях подготовка свежеубранного сырья заключалась в измельчении его на отрезки 0,5-3,0 мм в водной среде на лабораторном устройстве типа «блендер». Контролем служило сырье, измельченное на отрезки в 1-3 см. Навеску образцов листьев 300 г помещали в круглодонную колбу объемом 3 л, снабженную насадкой Клевенджера, и проводили гидродистилляцию в течение 4 ч. Эфирное масло экстрагировали из конденсата пентаном (4 мл). Полученный раствор обезвоживали, помещая на 12 ч в морозильную камеру. Пентан отделяли от эфирного масла термостатированием колбы при +52 °С на водяной бане. Компонентный состав эфирного масла мирта обыкновенного определяли методами ГХ с пламенно-ионизационным детектором (ПИД) и ГХ/МС. Газохроматографический анализ выполняли на хроматографе «Хроматек-Кристалл 2000 (Хроматэк, Россия) с пламенно-ионизационным детектором, совмещенным с системой сбора и обработки хроматографической информации «Хроматэк Аналитик 2,5». Идентификацию веществ проводили на хромато-масс-спектрометре ТRACE DSQ фирмы Thermo (газовый хроматограф TRACE GC Ultra и масс-спектрометр DSQ) в режиме полного ионного тока (энергия электронов 70 эВ). Условия определения компонентов эфирных масел в обоих методах были одинаковы: программирование температуры термостата колонок 40 °С (4 мин) – 4 °С/мин – 300 °С (32 мин); кварцевая капиллярная колонка CR – 5 ms, длина – 30 м, внутренний диаметр – 0,25 мм. Фаза – 5 % фенил 95 % полисилфениленсилоксан, толщина плёнки – 0,25 мкм. Температура термостата программировалась от 50 °С до 240 °С со скоростью 4 °С/мин. Температура испарителя – 280 °С. Газ-носитель – гелий, скорость потока 1 мл/мин. Температура переходной линии – 250 °С, температура источника ионов 200 °С. Электронная ионизация – 70 eV. Диапазон сканирования 20-450. Длительность скана – 0,2. Объем пробы эфирного масла – 0,2 мкл. Для расчета массовой доли компонентов применяли метод нормализации (Tкaчев, 2008; Adams, 2007). Содержание компонентов оценивали по площадям пиков, а идентификацию отдельных компонентов производили на основе сравнения времен удерживания и полных масс-спектров с соответствующими данными компонентов эталонных масел и чистых соединений (Boelens, 1991). Для идентификации также использовали данные библиотеки масс-спектров Wiley 275 (275 тыс. масс-спектров) и атласа масс-спектров и линейных индексов удерживания (Щипицина, 2010; Chryssavgi, 2008). Количественное содержание компонентов эфирного масла оценивали методом внутренней нормализации, измерения проводили в трехкратной повторности.
Результаты и обсуждение
Содержание эфирного масла в листьях составило 0,35±0,02 %. В эфирном масле мирта обыкновенного идентифицировано 30 компонентов из 90 обнаруженных. Массовая доля идентифицированных компонентов эфирного масла составила 65 % (табл. 1). Из идентифицированных компонентов монотерпены составляли 80,5 %, сесквитерпены – 25,5 %, спирты – 5,2 % и эфиры – 3,6 %.
Учитывали только компоненты, содержание которых в пробах составляет более 1 %, а степени совпадения экспериментальных масс-спектров с библиотечными были в пределах 95–99 %. Хроматограмма эфирного масла на полярной колонке CR листьев M. сommunis представлена на рисунке 2. На основании результатов настоящего исследования, α-пинен (27,2 %) (рис. 3) и 1,8-цинеол (26,4 %) (рис. 4), составляли самый высокий процент композиций. Этот результат соответствует предыдущим исследованиям. В большем количестве присутствуют α-терпинен (8,6 %), линалоол (13,0 %), α-терпинеол (6,6 %) и миртенил-ацетат (15,35 %), а также углеводород лимонен (D-Limonen) (6,4 %), определяющий аромат листьев мирта.
 Рис. 3. Структура α-пинена. |
 Рис. 4. Структура 1,8-цинеола. |
Ранее в литературе сообщалось о химическом составе масел мирта различного происхождения. Большинство масел имеют высокое содержание 1,8-цинеола. Содержание эфирного масла в листьях мирта колеблется от 0,02 % до 1,3 %. При произрастании в пределах Средиземноморского региона этот показатель в растениях колеблется от 0,2 до 0,8 %; за пределами этого ареала содержание основного компонента 1,8-цинеола также колеблется в широких пределах – от 4,91 до 42,43 %.
Масло, полученное из разных мест культивирования отличается по составу (табл. 2). В основном, это характерно для растений, произрастающих в странах Средиземноморья (Chalchat et al., 1998).
Таблица 1. Основные компоненты эфирного масла Myrtus communis L., полученного в условиях Апшерона
| № | Время удерживания | Компоненты | Массовая доля компонента, % |
| 1 | 8.62 | α-пинен(α-Pinene) | 27.2 |
| 2 | 8.98 | сaбинен (sabinen) | 0.96 |
| 3 | 9.35 | β-пинен(β-pinene) | 1.72 |
| 4 | 9.63 | мирцен (mircen) | 0.76 |
| 5 | 9.78 | 3-карен(3-carene) | 0.34 |
| 6 | 10.22 | α-терпинен(α-terpinene) | 8.65 |
| 7 | 10.40 | 1,8-цинеол (1,8-cineole) | 26.4 |
| 8 | 10.68 | лимонен(limonene) | 6.4 |
| 9 | 11.00 | тр-β-окимен(tr.β-ocimen) | 1.24 |
| 10 | 11.12 | γ-терпинен(γ-terpinene) | 0.50 |
| 11 | 13.01 | терпинолен(terpinolene) | 0.14 |
| 12 | 14.10 | линалоол (linaloole) | 13.0 |
| 13 | 14.52 | кариофиллен(cariofillene) | 0.01 |
| 14 | 15.22 | терпинен4-ол (terpinen4-ol) | 0.85 |
| 15 | 16.13 | α-терпинеол (α-terpineol) | 6.66 |
| 16 | 16.29 | кaмфен (kamfen) | 0.68 |
| 17 | 16.42 | миртенол (mirtenol) | 11.3 |
| 18 | 16.55 | нерол (nerol) | 0.06 |
| 19 | 16.92 | гераниол (geraniol) | 0.02 |
| 20 | 17.14 | миртенил ацетат (mirtenilacetate) | 15.35 |
| 21 | 17.28 | цитронелле бутирате (citronellybutyrate) | 0.06 |
| 22 | 17.62 | α-терпенил ацетат (α- terpenil acetat) | 1.44 |
| 23 | 19.63 | нерилацетат (nerilacetat) | 0.63 |
| 24 | 20.22 | геранил ацетат (geranyl acetate) | 1.0 |
| 25 | 21.50 | цедрол (cedrol) | 0.33 |
| 26 | 21.91 | 2-фенилетил тиглате (2-phenylethyl tiglate) | 0.01 |
Изучен состав эфирного масла мирта обыкновенного, произрастающего в Турции, Марокко, Алжире, Саудовской Аравии и в других странах (табл. 4). В этих исследованиях были идентифицированы эвкалиптол (1,8-цинеол), миртенол и α-пинен в качестве основных компонентов. Идентифицировали 65 соединений в эфирном масле M. communis, распространенного в центральном регионе Саудовской Аравии (Khan et al., 2014). Основные соединения: эвкалиптол (26,5 %), линалоол (18,0 %), α-пинен (11,6 %), α-терпинеол (8,9 %) и лимонен (4,0 %). В эфирном масле M. communis, собранном в Турции (Cakir et al., 2004), основными идентифицироваными соединениями были: α-пинен (26,81 %), 1,8-цинеол (4,91 %), терпинен-4-ол (4,2 %), α-терпинеол (4,1 %), линалил ацетат (8,88 %) и лимонен (35,13 %) (Özek et al., 2000). Было идентифицировано семнадцать соединений в эфирном масле M. communis, собранном в Тунисe, с миртенилацетатом (20,75 %), эвкалиптолом (16,55 %), а-пиненом (19,20 %), линалоолом (13,30 %), лимоненом (8,94 %), линалилацетатом (3,67 %), геранилацетатом (2,99 %) и α-терпинеолом (7,51 %) как основными соединениями (Messaoud et al., 2005). Было изучено масло, собранное на Южном берегу Крыма, где основными соединениями были: α-пинен (13,72 %), 1,8-цинеол (22,05 %), линалоол (16,60 %), миртенил ацетат (10,17 %), Д-лимонен (7,31 %), миртенол (9,26 %), линалил ацетат (5,72 %) (Логвиненко, 2017; Логвиненко и др., 2020).
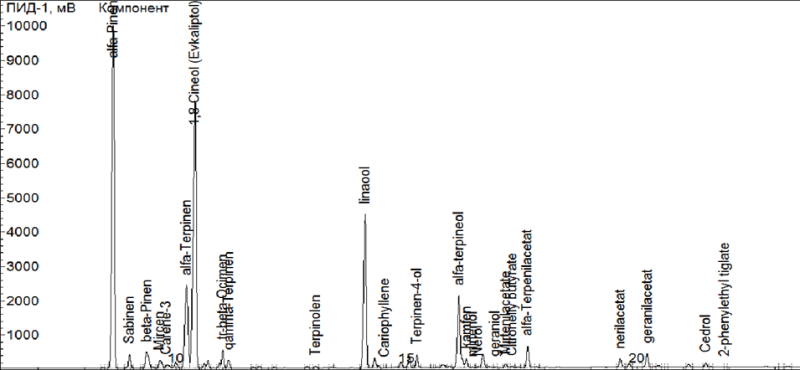
Рис. 2. Хроматограмма эфирного масла M. сommunis на полярной колонке CR.
Таблица 2. Состав эфирного масла листьев M. communis из разных мест произрастания (по литературным источникам)
| № | Место произрастания | Массовая доля эфирного масла на абсолютно сухой вес, % | Массовая доля 1,8-цинеола, % |
| 1 | Турция | 0.02 | 4.91 |
| 2 | Марокко | 0.20 | 42.43 |
| 3 | Индия | 0.3 | 28.62 |
| 4 | Арабия | 0.3 | 26.5 |
| 5 | Южный берег Крыма | 0.7 | 22.05 |
| 6 | Алжир | 1.3 | 35.3 |
| 7 | Тунис | 0.8 | 16.55 |
| 8 | Корсика | 0.4-0.5 | 25.4 |
| 9 | Испания | 0.6 | 15.4 |
| 10 | Иран | 0.6 | 26.9 |
| 11 | Албания | 0.4 | 21.8 |
Таблица 3. Качественный и количественный составы эфирного масла листьев M. сommunis по данным литературных источников
| Компоненты | Турция | Индия | Крым | Арабия | Тунис | Алжир | Иран | Мароккo | Испания | Албания | Корсика |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| α-пинен | 26.8 | 17.8 | 13.7 | 11.6 | 38.6 | 40.0 | 22.0 | 19.4 | 8.15 | 22.5 | 50.6 |
| лимонен | 35.1 | 1.7 | - | 4.0 | 8.94 | 18.5 | 10.4 | 5.75 | - | - | - |
| линалил ацетат | 8.88 | - | 5.72 | - | 3.67 | - | 8.64 | - | - | - | - |
| 1,8-цинеол | 4.91 | 28.6 | 22.0 | 26.5 | 16.6 | 45.3 | 26.9 | 42.4 | 15.4 | 21.8 | 25.4 |
| линалоол | - | 17.5 | 16.6 | 18.0 | 13.3 | - | 12.7 | 7.66 | 0.5 | 16.7 | - |
| α-терпинеол | 7.66 | - | - | 8.9 | 2.88 | - | 8.29 | 4.47 | - | - | - |
| миртенил ацетат | - | - | 10.1 | - | 20.7 | 17.5 | 15.9 | 21.2 | 35.9 | 17.7 | - |
| геранил ацетат | - | 6.3 | - | - | 2.99 | - | - | - | - | - | - |
| α-терпинолен | - | - | - | - | - | - | - | 20.8 | - | - | - |
| метилевгенол | - | - | - | - | - | - | - | 33.6 | - | - | - |
| α-терпинол | - | - | - | - | - | - | 4.21 | 18.0 | - | - | - |
| гераниол | - | 1.6 | - | - | - | - | - | - | - | - | - |
| α-гумулен | - | 1.5 | - | - | - | - | - | - | - | - | - |
| евгенол | - | 1.3 | - | - | - | - | - | - | - | - | - |
| миртенол | - | - | 9.26 | - | - | - | - | - | - | - | - |
| D-лимонен | - | - | 7.34 | - | - | - | - | - | - | - | - |
| линалил ацетат | - | - | 5.72 | - | - | - | 8.64 | - | - | - | - |
В эфирном масле мирта, собранного в Индии, основными соединениями были: α-пинен (17,8 %), 1,8-цинеол (28,62 %), линалоол (17,55 %), геранилацетат (6,3 %) (Sumbul et al., 2011). Эфирное масло экстрагировали из листьев M. сommunis в Марокко (Farah et al., 2006), и большей концентрацией в листьях обладали компоненты: 1,8-цинеол (42,43 %), α-пинен (19,39 %), лимонен (5,75 %), αтерпинолен (20,8 %), миртенил ацетат (21,25 %) и др. Изучены летучие компоненты листьев растения M. сommunis, произрастающего в Алжире. Компоненты с самым высоким содержанием были: в листьях: 1,8 цинеол (35,3 %), α-пинен (40,0 %), лимонен (18,5 %) и т. д. (Berka-Zougali et al., 2012). Среди них можно выделить две группы по наличию в заметных количествах или отсутствию миртенилацетата. Каждую группу можно дополнительно разделить на две подгруппы в соответствии с относительным соотношением α-пинена и миртенилацетата или α-пинена и 1,8-цинеола. В первой группе, испанское масло характеризовалось высоким содержанием миртенилацетата (35,9 %) и низким содержанием α-пинена (8,2 %), белые масла из Марокко (21,25 %) и Албании (Asslani, 2000) показали заметное количество α-пинена (19,39-22,5 %) и миртенилацетата (21,2-17,7 %). Во второй группе, масла из Алжира (17,5 %) и Ирана (Yadegarinia et al., 2006; Senatore et al., 2006) содержали одинаковое количество а-пинена и 1,8-цинеола, белые из Туниса (Messaoud et al., 2005) отличались от других высоким содержанием а-пинена (38,6 %), более чем в два раза превышающим содержание 1,8-цинеола.
Анализ данных по выходу из сырья и сравнение компонентов масла мирта показывает, что качество и количество масел сильно различаются в зависимости от страны происхождения. На изменение компонентного состава эфирного масла мирта, значительное влияние оказывают генетические и различные эколого-географические условия (Chryssavgi, 2008; Boelens, 1992).
Выводы и заключение
Впервые методом хромато-масс-спектрометрии установлен компонентный состав эфирного масла Myrtus communis L., выращиваемого в условиях коллекции Института дендрологии НАН Азербайджана. В условиях сухого субтропического климата средиземноморского типа на Апшероне в листьях растений M. communis по сравнению с растениями, растущими во влажных субтропиках, накапливается в два раза больше эфирного масла. Эфирное масло в условиях Апшерона отличается высоким содержанием основного действующего компонента α-пинена, 1,8-цинеола и ряда сложных эфиров, а также более низким содержанием кариофиллена.
Литература
Работягов В. Д., Хлыпенко Л. А., Бакова Н. Н., Машанов В. И. Аннотированный каталог видов и сортов эфиромасличных, пряно-ароматических и пищевых растений коллекции Никитского ботанического сада. Ялта: НБС-ННЦ, 2007. C. 48.
Абасова З. Г., Мамедова З. А., Мамедов Р. М. Интродукция некоторых перспективных лекарственных и эфиромасличных растений в Мардакянском дендрарии // Химия растительного сырья. 2009. № 1. С. 121—124.
Мамедов Т. С. Деревья и кустарники Апшерона // Наука и образование. 2010. С. 357.
Агамиров У. М. Мирт обыкновенный в условиях Апшерона // Генет. ресурсы лекарств. и аром. раст.: Межд. конф. Москва, 2002. С. 96.
Мамедов Ф. М. Мирт обыкновенный – перспективная для декоративного садоводство Апшерона культура // Интродукция и акклиматизация растений: Тр. Бот. сада. Баку, 1985. С. 46—50.
Государственная фармакопея СССР. ХI изд. Вып. 1. М., 1987. С. 335.
Ozek T., Demirci F., Başer K. H. C. Chemical composition of Turkish myrtle oil // Journal of Essential Oil Research. 2000. 12. P. 541—544.
Elfellah M. S., Akhter M. H., Khan M. T. Anti-hyperglycemic effect of an extract of Myrtus communis in streptozotocin-induced diabetes in mice // J. Ethnopharmacol. 1984. 11. P. 275—281.
Mansouri S., Foroumadi A., Ghaneie T., Najar A. G. Antibacterial activity of the crude extracts and fractionated constituents of Myrtus communis // Pharm. Biol. 2001. 39. P. 399—401.
Cakir A. Essential oil and fatty acid composition of Hippophae rhamnoides L. (Sea Buckthorn) and Myrtus communis L. from Turkey // Biochem. Syst. Ecol. 2004. 3. P. 809—816.
Jinous A., Arefeh A. Phytochemistry and pharmacological properties of Myrtus communis L. // Indian Journal of Traditional Knowledge. 2015. V. 1. P. 82—87.
Bouzouita N., Kachouri F., Hamdi M., Chaabouni M. Antimicrobial activity of essential oils from Tunisian aromatic plants // Flavour Frag. J. 2003. 18. P. 380—383.
Yadegarinia D., Gachkar L., Reyaei B., Taghizadeh M., Astaneh S. A., Rasooli I. Biochemical activities of Iranian Mentha piperita L. and Myrtus communis L. essential oils // Phytochemistry. 2006. 67. P. 1249—1255.
Машанов В. И. Покровский А. А. Заключение. Пряно-ароматические растения. М.: Агропромиздат, 1991. С. 287.
Jennings W., Shibamoto T. Qualitative analysis of Flavor and Volatiles by Glass Capillary Gas Chromatography // Academic Press Rapid Manuscript Reproduction. 1980. 472 p.
Ткачев А. В. Исследование летучих веществ растений. Новосибирск, 2008. С. 969.
Adams R. P. Identification of essential oil components by gas chromatography / mass spectrometry // The USA. Allured Publ. Carol Stream, 2007.
Boelens M., Jimenez R. The Chemical Composition of Spanish Myrtle Oils. Part II // J. Essent. Oil Res. 1992. 4. P. 349—353.
Щипицина О. С., Ефремов А. А. Компонентный состав эфирного масла различных вегетативных частей дудника лекарственного Сибирского региона // Химия растительного сырья. 2010. № 4. C. 115—119.
Chryssavgi G., Vassiliki P., Athanasios M., Kibouris T., Komaitis M. Essential oil composition of Pistacia lentiscus and Myrtus communis L.: Evaluation of the antioxidant capacity of methanolic extracts // Food Chem. 2008. 107. P. 1120—1130.
Chalchat J. C., Garry R. P. and Michet A. Essential oils of myrtle (Myrtus communis L.) of the Mediterranean littoral // J. Essent. Oil Res. 1998. 10. P. 613—617.
Khan M., Al-Mansour M. A., Mousa A. A., Alkhathlan H. Z. Compositional characteristics of the essential oil of Myrtus communis grown in the central part of Saudi Arabia // Journal of Essential Oil Research. 2014. 26. P. 13—18.
Логвиненко Л. А. Культура мирта (Myrtus communis L.) обыкновенного в условиях Южного берега Крыма // Аграрный вестник Урала. 2017. № 9 (163). C. 16—24.
Логвиненко Л. А., Дунаевская Е. В. Содержание биологически активных веществ в листьях Myrtus communis L. в условиях Южного берега Крыма // Аграрный вестник Урала. 2020. № 1 (192). С. 60—68.
Sumbul S., Ahmad M. A., Asif M. and Akhtar M. Myrtus communis Linn. // A review. Indian J. Na. Prod. Resour. 2011. 2. P. 395—402.
Farah A., Afifi A., Fechtal M., Chhen A., Satrani B., Talbi M., Chaouch A. Fractional distillation effect on the chemical composition of Moroccan myrtle (Myrtus communis L.) essential oils // Flavour and Fragrance Journal. 2006. 21. P. 351—354.
Berka-Zougali B., Ferhat M. A., Hassani A., Chemat F. and Allaf K. S. Comparative study of essential oils extracted from Algerian Myrtus communis L. leaves using microwaves and hydro distillation // Int. J. Mol. Sci. 2012. 13. P. 4673—4695.
Asslani U. Chemical composition of Albanian myrtle oil (Myrtus communis L.) // J. Essent. Oil Res. 2000. 12. P. 140—142.





