Введение
Виды рода Rhamnus являются ценными лекарственными, витаминными, техническими, медоносными и декоративными растениями, потенциальные возможности которых почти не использованы.
Значительный интерес, в этом плане, представляют такие виды как R. alnifolia, R. diamantica, R. cathartica, R. imeretina и R. tinctoria, которые, благодаря своим декоративным свойствам, могут широко использоваться в зеленом строительстве, в частности, они пригодны для создания живых изгородей, топиарных сооружений, солитерных посадок и украшения газонов (Деревья и кустарники СССР, 1962).
Перспективность расширения культуры этих растений в значительной степени зависит от разработки эффективных методов размножения.
Основными методами размножения видов рода Rhamnus является семенной и вегетативный, которые не всегда могут обеспечить необходимое количество растительного материала для нужд зеленого строительства.
Поэтому актуальным является использование альтернативного метода ― размножение в культуре in vitro, что позволяет решать важные проблемы растениеводства, а именно: в десятки и сотни раз увеличить коэффициент размножения растений, получить здоровый, безвирусный посадочный материал, а также с его помощью сохранить генофонд редких и исчезающих видов природной флоры (Кушнір, 2005).
Этот метод базируется на процессах адвентивной регенерации, во время которой адвентивные (придаточные) почки образуются не из первичных апикальных, а из вторичных боковых и раневых меристем в результате дедифференциации клеток, что позволяет повысить морфогенный потенциал растений, увеличить коэффициент размножения (Калинин, 1980). Стоит отметить, что морфогенный потенциал растительных клеток проявляется в культуре in vitro в более широком диапазоне по сравнению с природными условиями, благодаря эволюционно обусловленной способности сосудистых растений к регенерации (Журавлев, 2008).
Цель работы заключалась в подборе фитогормонального состав питательных сред в условиях культуры in vitro для достижения морфогенеза эксплантами R. alnifolia, R. diamantica, R. cathartica, R. imeretina и R. tinctoria.
Объекты и методы исследований
Материалом для исследований послужили микрочеренки, заготовленные из побегов с апикальными и пазушными почками, взятые из 3–5 летних растений в период их активного роста (вторая декада мая – третья декада июня). Экспериментальные исследования проводили в лаборатории микроклонального размножения растений Национального дендрологического парка «Софиевка» НАН Украины.
При культивировании эксплантов R. alnifolia, R. diamantica, R. cathartica, R. imeretina и R. tinctoria in vitro использовали метод индукции морфогенеза растений под действием регуляторов роста. Модификацию питательных сред Мурасиге и Скуга (МС) для индукции морфогенеза проводили с использованием пяти концентраций 6-бензиламинопурина (6-БАП), фитогормонов α-нафтилуксусная и α-нафтилуксусная (α-НУК) кислот, с добавлением витаминов и аминокислот (Murashige, 1962) (табл. 1).
С целью получения стерильного жизнеспособного растительного материала стерилизацию проводили в два этапа. Предварительная обработка осуществлялась дезинфицирующими растворами: "Биомой" (НПО ФАРМАКОС Украина) и "Септодор–Форте" (ВИК-А Украина), основная ― 0,1 % водным раствором дихлорида ртути (HgCl2). Для более эффективного действия к реагенту добавляли эмульгатор "Твин 80". Повторность опыта ― трехкратная. Посуду, материалы, инструменты и питательные среды готовили согласно методик Ф. Л. Калинина и В. А. Кунаха (1980, 2005). Пасаж эксплантов проводили через 26–30 суток.
Таблица 1. Содержание фитогормонов в модифицированных питательных средах
| Варианты питательных сред | Фитогормоны, мг/л | ||
| БАП | НУК | ИМК | |
| I | 0,5 | 0,5 | — |
| II | 1,0 | 1,0 | — |
| III | 1,5 | — | 0,5 |
| IV | 2,0 | — | 1,0 |
| V | 2,5 | 0,1 | 0,1 |
Результаты и обсуждение
Полученный стерильный жизнеспособный материал высаживали на питательные среды Мурасиге и Скуга с различным содержанием регуляторов роста.

Рис. 1. Введение R. diamantica in vitro.
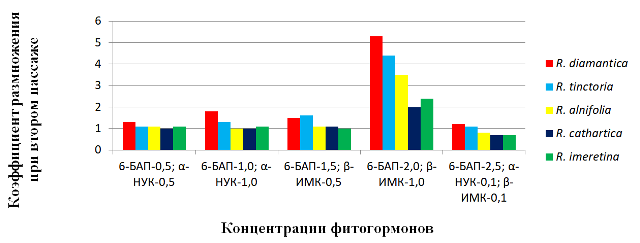
Рис.2. Коэффициент размножения в зависимости от фитогормонального состава питательных сред.
В течение 25–30 суток с момента переноса эксплантов на питательные среды, наблюдали разрастание с разной интенсивностью базальной части эксплантов и формирование зачатков адвентивных почек. Это послужило началом прямого морфогенеза, при котором путем активации меристемних тканей и дедифференциации клеток начинали формирование адвентивные почки, из которых в течение 15–23 суток начинался рост побегов. Через 20–25 суток от начала роста, в зависимости от содержания фитогормонов в питательных средах и их концентраций, побеги достигли 0,5–1,8 см. По результатам исследования выявлено существенное различие между вариантами как по росту эксплантов, так и по коэффициенту размножения, что является основным показателем морфогенного потенциала эксплантов (рис. 2). По результатам использования многочисленных модификаций сред были отобраны наиболее эффективные.
Под влиянием различных концентраций фитогормонов наиболее активно процессы морфогенеза происходили на среде IV при концентрации в питательной среде 6-БАП ― 2,0 мг / л, β-ИМК ― 1,0 мг / л, где коэффициент размножения при втором пассаже составил в R. diamantica ― 5,3, у R. tinctoria ― 4,4, R. alnifolia ―3,5. У R. cathartica и R. imeretina коэффициент размножения был значительно ниже и соответственно составил 2,0 и 2,4.

Рис. 3. Морфогенез R. diamantica in vitro.
Питательные среды с меньшим содержанием 6-БАП (0,5–1,5 мг / л) обеспечивали хороший рост побегов, однако коэффициент размножения был значительно меньше и составлял, соответственно, у R. diamantica ― 1,3; 1,8 и 1,5, а у R. tinctoria ―1,1; 1,3 и 1,6. У видов R. alnifolia, R. cathartica и R. imeretina коэффициент размножения составил 1. Повышенное содержание 6-БАП (2,5 мг / л) с добавлением 0,1 мг / л α–НУК и 0,1 мг / л β–ИМК значительно уменьшал коэффициент размножения, который составил в R. diamantica ― 1,2, у R. tinctoria ― 1,1, а у R. alnifolia, R. cathartica и R. imeretina был ниже уровня 1.
Выводы и заключение
В результате проведенных исследований установлено, что морфогенез эксплантов R. alnifolia, R. diamantica, R. cathartica, R. imeretina и R. tinctoria зависит от количественного содержания фитогормонов в питательных средах. Наиболее эффективной была питательная среда с содержанием 6-БАП ― 2,0 мг / л и β-ИМК ― 1,0 мг / л, что способствовало активному прохождению процессов морфогенеза. Наиболее высоким коэффициент размножения при втором пассаже был у эксплантов R. diamantica ― 5,3, R. tinctoria ― 4,4, R. alnifolia — 3,5. У R. cathartica и R. imeretina этот показатель был намного меньше и составлял соответственно 2,0 и 2,4. Уменьшение и увеличение концентраций приводило к понижению показателей коэффициента размножения по всем видам.
Литература
Соколов С. Я., Артюшенко З. Т., Гусев Ю. Д., Зайцев Г. Н. и др. Деревья и кустарники СССР. М.: Изд-во АН СССР, 1962. Т. 4. 974 с.
Журавлев Ю. Н., Омелько А. М. Физиология растений. Морфогенез у растений in vitro. 2008. Т. 55. № 5. С. 643—664.
Калинин Ф. Л., Сарнацкая В. В., Полищук В. Е. Методы культуры тканей в физиологии и биохимии растений. К.: Наукова думка, 1980. 488 с.
Кунах В. А. Біотехнологія лікарських рослин. Генетичні та фізіолого-біохімічні основи. К.: Логос, 2005. 730 с.
Кушнір Г. П., Сарнацька В. В. Мікроклональне розмноження рослин, теорія і практика. К.: Наукова думка, 2005. 242 с.
Murashige T. A revised medium for rapid growth and bioassay with tobacco tissue culture / T. Murashige, F. K. Skoog // Physiol. Plant. 1962. Vol. 15. Р. 473—497.





